一、走进化学世界
请收藏丨初三化学知识点总结
1. 化学变化:生成了其它物质的变。
2. 物理变化:没有生成其它物质的变化。
3. 物理性质:不需要发生化学变化就表现出来的性质,如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等。
4. 化学性质:物质在化学变化中表现出来的性质,如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等。
5. 常用仪器及使用方法
① 用于加热的仪器:试管、烧杯、蒸发皿、燃烧匙。
② 测容器:量筒(视线与量筒内液体凹液面的最低点保持水平)。
③ 称量器:托盘天平(左物右码)。
④ 加热器皿:酒精灯。
⑤ 分离物质及加液的仪器:漏斗、长颈漏斗、分液漏斗。
6. 化学实验基本操作

二、空气
1. 组成:N2:78%、O2:21%、稀有气体:0.94%、CO2:0.03%,其它气体与杂质 0.03%。
2. 空气中氧气的测定(原理:压强差)
(1) 可燃物要求:足量且产物是固体,红磷。
(2) 装置要求:气密性良好 操作要求:冷却到室温后打开弹簧夹。
(3) 现象:放热,有大量白烟产生,打开弹簧夹后,广口瓶内液面上升约1/5体积。
(4) 结论:O2约占空气体积的1/5。
(5) 探究:
① 液面上升小于1/5原因:
装置漏气,红磷量不足,未冷却完全。
② 能否用铁、镁代替红磷?
不能,原因:铁不能在空气中燃烧,镁会与N2、CO2反应。
③ 能否用碳、硫代替红磷?
不能,原因:产物是气体,不能产生压强差。
3. 氧气的性质和制备
(1)氧气的化学性质:支持燃烧,供给呼吸。

-
铁在氧气中燃烧烧集气瓶中放少量水或细砂的目的:防止溅落的高温熔化物炸裂瓶底。
-
硫在氧气中燃烧集气瓶中放入少量水的目的:吸收SO2,防止其污染空气。
(2)氧气的制备:
① 工业制氧气——分离液态空气法(原理:液氮和液氧的沸点不同,物理变化)
② 实验室制氧气原理:
a. 气体制取与收集装置的选择
发生装置:固固加热型、固液不加热型 (根据反应物的状态和反应条件)
收集装置:根据气体的密度、溶解性。
b. 制取氧气的操作步骤(以高锰酸钾制取氧气并用排水法收集为例)
查—装—定—点—收—离—熄。
c. 催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质。(一变两不变)。
4. 常见气体的用途:
(1)氧气:供呼吸 (如潜水、医疗急救)。
支持燃烧 (如燃料燃烧、炼钢、气焊)。
(2)氮气:保护气(化性不活泼)、重要原料(硝酸、化肥)、液氮冷冻。
(3)稀有气体(He、Ne、Ar、Kr、Xe等的总称):保护气、电光源(通电发不同颜色的光)、激光技术。
5. 常见气体的检验方法
(1)氧气:带火星的木条。
(2)二氧化碳:澄清的石灰水。
(3)氢气:将气体点燃,用干冷的烧杯罩在火焰上方;或者,先通过灼热的氧化铜,再通过无水硫酸铜。
三、物质构成的奥秘
1. 分子
(1)概念:由分子构成的物质,分子是保持物质化学性质最小的微粒,化学变化中可分。
(2)三个基本性质(一小二动三间隔)。
(3)影响因素(温度、压强)。
2. 原子
(1)概念:原子是化学变化中的最小微粒,化学变化中不可分 。
(2)三个基本性质(一小二动三间隔)。
(3)构成:原子核(质子〔+〕、中子)和核外电子〔-〕。
-
核电荷数=质子数=核外电子数=原子序数
-
相对原子质量≈质子数+中子数
3. 离子
(1)概念:带电的原子或原子团。
(2)表示方法及意义:如Fe3+:一个铁离子带3个单位正电荷。
4. 元素
(1)概念:具有相同核电荷数(质子数)的一类原子的总称。
(2)质子数决定元素种类。
(3)元素的化学性质与原子最外层电子数密切相关。
注:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)。最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)。
5. 化合价和化学式
(1)化合价
a. 写法及意义:
MgCl2:氯化镁中镁元素化合价为+2价。
b. 几种数字的含义:
Fe2+:每个亚铁离子带两个单位正电荷。
3 Fe2+:3个亚铁离子。
c. 化合物中各元素正、负化合价的代数和为零,单质中元素化合价为零。
(2)化学式
① 写法:
a. 单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2。
b. 化合物:正价在前,负价在后(NH3、CH4除外)。
② 意义:
如化学式H2O的意义:4点;
化学式 Fe的意义:3点。
③ 计算:
a. 计算相对分子质量=各元素的相对原子质量×原子个数之和。
b. 计算物质组成元素的质量比:相对原子质量×原子个数之比。
c. 计算物质中某元素的质量分数。
四、自然界的水
1. 水
(1)水的组成
-
测定方法和原理(电解水)
-
结论:水是由氢氧元素组成的,H2(负极)与O2(正极)的体积比为2:1,质量比为1:8。
(2)自来水的净化过程和净化原理
-
沉淀——过滤——吸附——消毒。
-
活性炭作用:吸附(色素和异味)。
-
区分硬、软水方法:肥皂水。
-
水的两种软化方法:(生活中)煮沸,(实验室)蒸馏。
2. 物质分类
-
混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质。
-
纯净物:由一种物质组成。
-
单质:由同种元素组成的纯净物。
-
化合物:由不同种元素组成的纯净物。
-
氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素。
五、化学方程式
1. 质量守恒定律
(1)概念(反应物和生成物前后质量不变)。
(2)原因(三不变:原子种类、数目、质量反应前后不变)。
(3)化学方程式有关计算。
说明:
-
质量守恒定律只适用于化学变化,不适用于物理变化。
-
不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中。
-
要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏。
2. 基本反应类型
-
化合反应:由两种或两种以上物质生成另一种物质的反应。
-
分解反应:由一种反应物生成两种或两种以上其他物质的反应。
-
置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应。
六、碳和碳的氧化物
1. 碳的几种单质
(1)金刚石(C)是自然界中最硬的物质,可用于制钻石、刻划玻璃、钻探机的钻头等。
(2)石墨(C)是最软的矿物之一,有优良的导电性,润滑性。可用于制铅笔芯、干电池的电极、电车的滑块等。
金刚石和石墨的物理性质有很大差异的原因是:碳原子的排列不同。
CO和CO2的化学性质有很大差异的原因是:分子的构成不同。
(3)无定形碳:由石墨的微小晶体和少量杂质构成.主要有:焦炭,木炭,活性炭,炭黑等。
2. 单质碳的化学性质:
单质碳的物理性质各异,而各种单质碳的化学性质却相同!
(1)常温下的稳定性。
(2)可燃性:
-
完全燃烧(氧气充足),生成CO2;
-
不完全燃烧(氧气不充足),生成CO。
(3)还原性:C+2CuO ═ 2Cu+CO2↑(置换反应)
-
应用:冶金工业
-
现象:黑色粉末逐渐变成光亮红色,石灰水变浑浊。
-
2Fe2O3+3C ═ 4Fe+3CO2↑
3. 二氧化碳的制法
(1)二氧化碳的实验室制法
① 原理:用石灰石和稀盐酸反应:
CaCO3+2HCl ═ CaCl2+H2O+CO2↑
② 选用固液不加热装置
③ 气体收集方法:向上排空气法
④ 验证方法:将制得的气体通入澄清的石灰水,如能变浑浊,则是二氧化碳。
验满方法:用点燃的木条,放在集气瓶口,木条熄灭。则已集满二氧化碳
(2)二氧化碳的工业制法:
-
煅烧石灰石:CaCO3 ═ CaO+CO2↑
-
生石灰和水反应可得熟石灰:CaO+H2O═Ca(OH)2
4. 二氧化碳的性质
(1)物理性质:无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体:干冰。
(2)化学性质:
① 一般情况下不能燃烧,也不支持燃烧,不能供给呼吸
② 与水反应生成碳酸:CO2+H2O═H2CO3。生成的碳酸能使紫色的石蕊试液变红,
H2CO3 ═H2O+ CO2↑。碳酸不稳定,易分解。
③ 能使澄清的石灰水变浑浊:
CO2+Ca(OH)2 ═ CaCO3↓+H2O 。用于检验二氧化碳。
④ 与灼热的碳反应:
C+CO2 ═ 2CO(吸热反应)
(3)用途:灭火
-
原理:Na2CO3+2HCl ═ 2NaCl+H2O+CO2↑
-
既利用其物理性质,又利用其化学性质
-
干冰用于人工降雨、制冷
5. 一氧化碳
(1)物理性质:无色,无味的气体,密度比空气略小,难溶于水。
(2)有毒:吸进肺里与血液中的血红蛋白结合,使人体缺少氧气而中毒。
(3)化学性质:(H2、CO、C具有相似的化学性质:①可燃性 ②还原性)
① 可燃性:
2CO+O2 ═ 2CO2 (可燃性气体点燃前一定要检验纯度)
-
H2和O2的燃烧火焰是:发出淡蓝色的火焰。
-
CO和O2的燃烧火焰是:发出蓝色的火焰。
-
CH4和O2的燃烧火焰是:发出明亮的蓝色火焰。
鉴别:H2、CO、CH4可燃性的气体:看燃烧产物(不可根据火焰颜色)
② 还原性:
CO+CuO ═Cu+CO2 。
-
应用:冶金工业。
-
现象:黑色的氧化铜逐渐变成光亮红色,石灰水变浑浊。
Fe2O3+3CO ═ 2Fe+3CO2。(现象:红棕色粉末逐渐变成黑色,石灰水变浑浊。)
除杂:CO[CO2] 通入石灰水 或氢氧化钠溶液:
CO2+2NaOH═Na2CO3+H2O
CO2[CO] 通过灼热的氧化铜
CO+CuO ═ Cu+CO2
CaO[CaCO3]只能煅烧(不可加盐酸)
CaCO3 ═ CaO+CO2↑
注意:检验CaO是否含CaCO3加盐酸 :
CaCO3+2HCl═CaCl2+H2O+CO2↑
(CO32-的检验:先加盐酸,然后将产生的气体通入澄清石灰水。)
七、燃料及应用
1. 燃烧和灭火
(1)燃烧的条件:(缺一不可)
可燃物;氧气(或空气);温度达到着火点
(2)灭火的原理:(只要消除燃烧条件的任意一个即可)
消除可燃物;隔绝氧气;降温到着火点以下
(3)影响燃烧现象的因素:
可燃物的性质、氧气的浓度、与氧气的接触面积
(4)使燃料充分燃烧的两个条件:
要有足够多的空气;燃料与空气有足够大的接触面积。
2. 化石燃料
(1)三大化石燃料:煤、石油、天然气(主要成分甲烷)
甲烷的化学式:CH4 (最简单的有机物,相对分子质量最小的有机物)
物理性质:无色,无味的气体,密度比空气小,极难溶于水。
化学性质: 可燃性。
CH4+2O2═CO2+2H2O (蓝色火焰)。
(2)乙醇
乙醇(俗称:酒精,化学式:C2H5OH)
化学性质: 可燃性
C2H5OH+ 3O2═2CO2+3H2O
优点:
减少环境污染;节约化石燃料;促进农业发展。
(3)新能源:
氢能源(最清洁的能源)、太阳能、核能、风能、地热能、潮汐能
8. 金属和金属材料
1. 物理性质
(1)金属的物理性质:
a. 常温下一般为固态(汞为液态),有金属光泽。
b. 大多数呈银白色(铜为紫红色,金为黄色)
c. 有良好的导热性、导电性、延展性
(2)合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质.
铁合金——生铁和钢:主要成份都是铁,但含碳量不同
钛合金:熔点高、密度、机械性能好、耐腐蚀性强、“相溶性”等
2. 金属的化学性质
(1)大多数金属可与氧气的反应
(2)金属 + 酸 → 盐 + H2↑
(3)金属 + 盐 → 另一金属 + 另一盐
(条件:“前换后,盐可溶”)
Fe + CuSO4 ═ Cu + FeSO4 (“湿法冶金”原理)
3. 常见金属活动性顺序:
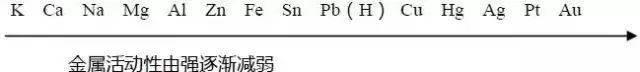
在金属活动性顺序里:
① 金属的位置越靠前,它的活动性就越强
② 位于氢前的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)
③ 位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na)
4. 金属资源的保护和利用
(1)铁的冶炼
a. 原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。
3CO + Fe2O3 ═ 2Fe + 3CO2
b. 原料:铁矿石、焦炭、石灰石、空气
c. 常见的铁矿石:磁铁矿(主要成分是Fe3O4 )、赤铁矿(主要成分是Fe2O3 )
(2)铁的锈蚀
a. 铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3·XH2O)
铜生铜绿的条件:铜与O2、水、CO2接触;
铜绿的化学式:Cu2(OH)2CO3。
b. 防止铁制品生锈的措施:
① 保持铁制品表面的清洁、干燥;
② 表面涂保护膜:如涂油、刷漆、电镀等;
③ 制成不锈钢。









 公安备案号:37020202000242
公安备案号:37020202000242